
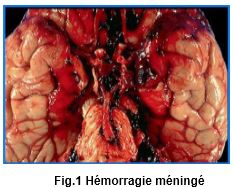
I. Introduction-définition :
L’hémorragie méningée, ou hémorragie sous-arachnoïdienne,
est une entité anatomo-clinique, conséquence de la présence de sang
dans les espaces sous-arachnoïdiens. « Sont exclue les hémorragies
sous durales, extradurales ou intracérébrales ». Fig. 1
Sur le plan nosologique, l’hémorragie méningée est une sous-classe d’accident vasculaire cérébral, aux côtés des accidents ischémiques et des hématomes intra parenchymateux.
II. Intérêt de la question :
- Incidence : 10/100 000 individus dans la plupart des séries.
- Diagnostic : basé sur la clinique +TDM (sans produit de contraste) +/- examen du LCR à la phase aiguë.
- Etiologie :
- La principale étiologie est la rupture d’un anévrisme vasculaire intracrânien (80 %),
- D’autres pathologies malformatives ou dégénératives vasculaires, infectieuses, inflammatoires ou traumatiques,
- Ainsi que l’hémorragie péri-mésencéphalique d’étiologie indéterminée et de pronostic propre, sont à l’origine de 20 % des causes restantes.
- Thérapeutique : prise en charge en structure de neuro-réanimation.
- Pronostic L’évolution est +/- péjorative d’une façon générale.
- Epidémiologie :
- Incidence. Prévalence : L’incidence mondiale de l’hémorragie méningée est de 10/100 000 individus, et varie avec le groupe ethnique étudié et la région géographique (Finlande, Nouvelle Zélande +++).
- Age : pics à 55 ans (masculin), 60 ans (Féminin).
- Sexe : Femmes plus que les hommes.
- Rythmes circadiens : On note l’existence d’un pic d’incidence en fin de matinée lié à une augmentation de la pression artérielle.
- Rythmes circannuels : Il est retrouvé une incidence supérieure d’hémorragie sous-
arachnoïdienne durant la saison hivernale, et il existe une association avec des facteurs
météorologiques (taux bas d’humidité, température basse, durée brève de l’ensoleillement).

- Facteurs de risque (FDR) :
- FDR modifiables :Tabagisme : risque dose-dépendant.
- Alcoolisme : risque dose-dépendant.
- HTA : risque augmenté si associée au tabagisme.
- Contraception œstro-progestative controversée.
- Cocaïne.
- Traitement anticoagulant.
- FDR non modifiables :Polykystose rénale autosomique dominante.
- Anévrysme intracrânien familial.
- Facteurs prédisposant :
- Activité physique : dans 50 % des cas, la symptomatologie de l’HSA débute au cours d’une activité physique, en particulier lors d’un effort soutenu (soulèvement d’une charge…) ou de l’activité sexuelle.
- Séjour en haute altitude : il existe une association entre un séjour en altitude (plus de 2 500 mètres) et la survenue d’une HSA, passant possiblement par une diminution de la pression atmosphérique, et l’augmentation du débit sanguin cérébral.
- Prise aiguë de toxiques : la prise aiguë de drogues sympathomimétiques illicites, mais également une intoxication éthylique aiguë ou la prise aiguë de tabac sont associées au risque de survenue d’une HSA.
IV. Diagnostic positif :
- Clinique :
- Tableau clinique typique :
- Céphalée brutale, d’intensité importante, fréquemment décrite par le patient comme le plus horrible mal de tête de son existence. Rapidement, s’associent des nausées et des vomissements. Il s’agit d’une céphalée en « coup de tonnerre », se développant en quelques secondes, atteignant son maximum d’intensité sur 1 à quelques minutes, et diminuant sur une période allant de quelques heures à quelques jours.
- Un syndrome méningé avec une raideur nucale,
- Des troubles de la vigilance,
- Des signes neurologiques focaux dont certains orientent préférentiellement vers une étiologie :
§ Une paralysie du nerf oculomoteur, vers un anévrisme de l’Artère communicante antérieure.
§ Une faiblesse des membres inférieurs bilatérale ou une aboulie, vers un anévrisme de l’AComA.
§ Un nystagmus ou un syndrome cérébelleux, vers une hémorragie de la fosse postérieure.
§ Une aphasie, une hémiparésie ou une négligence visuelle, vers un anévrisme de l’ACM.
- Un syndrome de Terson (hémorragie vitréenne associée à l’HSA).
- Une hyperthermie apparaitra aux 4eme 5eme jours, elle reflète la gravité de l’hémorragie : plus elle est élevée plus l’hémorragie est importante.
- Scores pronostiques : Deux scores pronostiques sont utilisés de préférence : le score de Hunt et Hess et le score pronostique de la World Fédération of Neurological Surgeons (WFNS).

Grade Score de Hunt et Hess
0 : Anévrysme non rompu
I : Asymptomatique ou céphalée minime
II: Céphalée modéré à sévère, raideur de la nuque, paralysie du nerf crâniens
III: Somnolence ,confusion, déficit focal minime
IV : Etat stuporeuse, hémiparésie modéré à sévère ébauche de décérébration
V : Coma profond décérébration moribond
Score de WFNS
Anévrysme non rompu
Score de Glasgow
(SCS=15
GCS=13-14 sans un
déficit focal
GCS=13-14 avec un
déficit focal
GCS = 7-12
GCS = 3-6
2.Autres présentations cliniques : Environ 50 % des patients présentent des variations sémiologiques
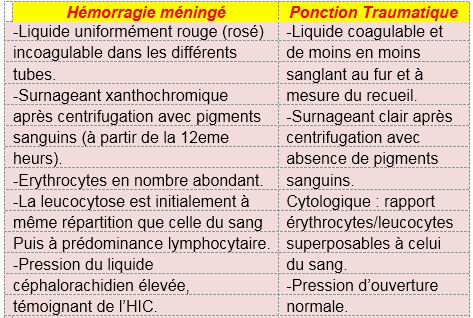
- Ponction lombaire : Contre indiquée si signe de localisation neurologique faisant craindre un hématome intra parenchymateux (risque d’engagement cérébral).
Elle n’est réalisée que si le scanner cérébral est normal.
La normalité d’une ponction lombaire 12 heures après le début de la céphalée (avec notamment absence de xanthochromie) permet d’éliminer le diagnostic d’hémorragie méningée.
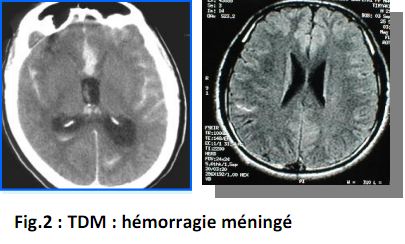
4. Imagerie médicale :
a. Tomodensitométrie (TDM) :
L’examen-clé du diagnostic, à réaliser de toute urgence : Une hyperdensité spontanée dans les espaces sous-arachnoïdiens : (sillons corticaux et vallées sylviennes, citernes de la base, scissure inter hémisphérique : localisation de la rupture vasculaire : prédominance de l’hémorragie dans région cérébrale. Plus rarement en montrant directement un anévrysme (calcifications de la paroi anévrysmale). Fig.2 Cherche des complications précoces : hématome intra parenchymateux associé, rupture intra ventriculaire, hydrocéphalie aiguë. Le scanner est normal dans deux circonstances (20 % des cas environ) : * hémorragie discrète.
4. Imagerie médicale :
a. Tomodensitométrie (TDM) :
L’examen-clé du diagnostic, à réaliser de toute urgence : Une hyperdensité spontanée dans les espaces sous-arachnoïdiens : (sillons corticaux et vallées sylviennes, citernes de la base, scissure inter hémisphérique : localisation de la rupture vasculaire : prédominance de l’hémorragie dans région cérébrale. Plus rarement en montrant directement un anévrysme (calcifications de la paroi anévrysmale). Fig.2 Cherche des complications précoces : hématome intra parenchymateux associé, rupture intra ventriculaire, hydrocéphalie aiguë. Le scanner est normal dans deux circonstances (20 % des cas environ) : * hémorragie discrète.

- hémorragie ancienne (disparition de l’hyperdensité sanguine en 5 à 8jours).
- Classification Scannographique de l’hémorragie méningée
| Grade de Fisher | Aspect Scannographique |
| 1 | Absence de sang. |
| 2 | Uniquement dans les ESA < 1 cm d’épaisseur. |
| 3 | Uniquement dans les ESA ≥ 1 cm d’épaisseur. |
| 4 | Caillot sanguin intra parenchymateux ou intraventriculaire +/- HSA diffuse. |
b. Angioscanner cérébrale :
Cet examen est devenu l’examen de référence dans l’exploration en urgence des hémorragies sous-arachnoïdiennes. Le traitement chirurgical peut être réalisé sur cette seule base dans la plupart des cas. Car cette examen permet : (Fif.2)
• De mettre en évidence des anévrismes de plus de 2 à 3mm, avec une sensibilité allant de 77 à 97 %, et une spécificité de 87 à 100 % en fonction des équipes.
• La mesure exacte de la taille d’un anévrisme partiellement thrombosé, et les rapports anatomiques exacts de l’anévrisme.
• Le développement du scanner avec acquisition hélicoïdale a permis de réduire nettement le temps d’acquisition, et de ce fait les artefacts liés aux mouvements.
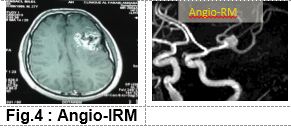
c. Angio-IRM:
• De plus en plus utilisée.
• Permet un diagnostic plus précoce.
• Couplée à l’angiographie, elle permet un diagnostic étiologique
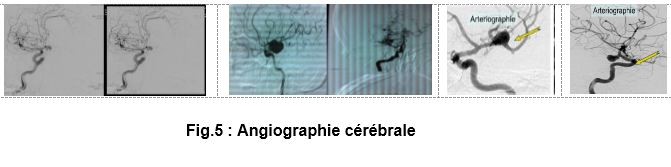
d. Angiographie cérébrale conventionnelle :
• L’examen de référence, réaliser en urgence.
• Met en évidence l’anévrisme artériel : image d’addition opacifiée aux temps artériels précoces
• Précise son volume, ses rapports avec les axes vasculaires, sa forme, le siège du collet.
• Elle recherche des anévrismes multiples (20 % des cas) et un spasme artériel secondaire (généralement après quelques jours).
• Elle est parfois normale malgré l’existence d’un anévrisme (masqué par le spasme associé), et est alors rediscutée à distance (6 à 8 semaines).(Fig.4)

B. Diagnostic différentiel :
Toute céphalée aiguë et inhabituelle doit faire rechercher une hémorragie sous-arachnoïdienne. Dans les cas de céphalées aiguës modérées ou minimes, on ne doit pas évoquer une arthrose cervicale, une encéphalopathie hypertensive, une étiologie psychiatrique…, avant d’avoir éliminé une hémorragie sous-arachnoïdienne.
V. Principales étiologies
A. L’anévrisme artériel : est
La principale cause (60% des hémorragies méningées).
Il s’agit d’une dilatation sacciforme (rarement fusiforme) de l’artère avec zone d’implantation : collet.
Histologiquement : zone de fragilité pariétale malformative, avec disparition de la média et fragmentation de la lame élastique interne responsable d’une expansion vers l’extérieur du vaisseau des couches internes de la paroi.
Peut augmenter progressivement de taille, sous l’influence notamment d’une hypertension artérielle mal contrôlée
Les localisations préférentielles :
o La terminaison de l’artère carotide et l’artère communicante antérieure. De l’artère cérébrale moyenne.
o D’autres : (terminaison du tronc basilaire, artère cérébrale antérieure, …).
Les facteurs majorant le risque de rupture :
o La taille de l’anévrisme : Le risque est extrêmement faible au-dessous de 10 mm
o Plus fréquente chez la jeune femme.
o Les à-coups tensionnels jouent probablement un rôle mais la preuve en est délicate.
B. Autres causes
malformation artérioveineuse Hémorragie cérébroméningée
Traumatisme contusion hémorragique corticale avec hémorragie méningée de contamination.
Anévrismes mycotiques, secondaires à une embolie septique (endocardite infectieuse).
Angiopathies d’origine diverse (angéites inflammatoires, abus d’amphétamines, dissection d’une artère intracrânienne, etc…)
Artérites :
o Maladie de Wegener.
o Borréliose de Lyme.
o Angéite du post-partum.
Drépanocytose :y
Dysplasie fibro-musculaire intracérébrale :
Dissection vasculaire :

- Vertébrale :
- Carotidienne :
- Toxicomanie : Cocaïne +++, amphétamines.
- Apoplexie pituitaire : + signes ophtalmologiques.
- Endométriose : Extrêmement rare.
- Néoplasie : Exceptionnellement.
- Saignements d’origine spinale :
- Troubles de la coagulation :
- Hémorragie sous-arachnoïdienne d’étiologie indéterminée (Hémorragie péri- mésencéphalique) :
- Absence de cause identifiée (20 à 25% des cas).
Þ Reprise des investigations à distance du premier bilan
I. Complications :
A. Resaignement :
Environ 40 % des patients présentant une HSA décèdent de l’hémorragie initiale.
Pour les patients qui survivent à l’accident initial, le risque de resaignement durant les 2 premières semaines est de l’ordre de 25 % si l’anévrisme est resté non traité.
La mortalité du resaignement est de l’ordre de 75 %, et les survivants présentent en général un état clinique péjoratif et un plus mauvais devenir, que les patients n’ayant présenté que l’épisode de saignement initial.
Dans 17 % des cas, le resaignement survient dans les 12 premières heures, entraînant une mortalité importante.
D’autre part, en cas de resaignement, il existe un risque supplémentaire d’hémorragie intracérébrale associée.
L’investigation par angiographie conventionnelle, méthode d’investigation plus longue et à l’origine de plus de stress sur le plan vasculaire, entraîne un risque de resaignement très précoce plus élevé que les techniques non invasives.
B.Vasospasme :
- Le vasospasme débute en général autour du 3ème jour après l’hémorragie, et le risque maximal est atteint entre le 6ème et le 8ème jour. Se caractérisant par des troubles de la vigilance précédant un déficit neurologique focal.
- Le mécanisme du vasospasme est encore controversé. L’hémoglobine au contact de l’adventice des artères cérébrales est le principal médiateur de la genèse de ce dernier. En effet, la quantité de sang située au niveau de l’espace sous-arachnoïdien est le facteur principal de sévérité du vasospasme. Le taux d’hémoglobine au niveau du LCR augmente parallèlement à la lyse des globules rouges, et ceci explique la nature retardée du vasospasme par rapport à l’hémorragie.
C.Hydrocéphalie :
Cette complication est présente chez environ 15 à 20 % des patients présentant une HSA., Elle conduit à un pronostic plus péjoratif (mortalité au cours du 1er mois supérieure). Le tableau clinique se caractérise par un déclin progressif du niveau de conscience, l’apparition d’un myosis bilatéral, avec la préservation des autres réflexes du tronc.
Le scanner cérébral retrouve une augmentation de la taille des ventricules. Les facteurs corrélés à l’hydrocéphalie aiguë sont :
- Facteurs généraux : âge avancé, HTA préexistante ;

- Évaluation clinique : HTA, diminution du niveau de conscience, déficit neurologique focal ;
- Évaluation biologique : hyponatrémie ;
- Évaluation scannographique : hémorragie intraventriculaire, présence d’une topographie diffuse du saignement sous-arachnoïdien, présence de collections focales au niveau de l’espace sous-arachnoïdien ;
- Topographie anévrismale : anévrismes de la circulation vertébro-basilaire ;
- Attitudes thérapeutiques : utilisation d’un traitement anti-fibrinolytique préopératoire.
A. Complications médicales extraneurologiques:
- Anomalies cardiaques : troubles de rythme, OAP…
- Autres : troubles infectieux, hématologiques, hépatiques et rénaux sont ceux que l’on rencontre chez tous les patients cérébrolésés graves nécessitant une réanimation lourde.
La proportion de décès liés à des complications médicales est de l’ordre de 23 %.
I.Traitement :
A. Moyens :
- Moyens généraux :
- Traitement anticomitial : est recommandée chez tout patient ayant présenté une crise comitiale à la phase aiguë de l’hémorragie sous-arachnoïdienne, et doit être poursuivie au moins durant une période brève. Cela revient à traiter environ 25 % des patients.
§ Inhibiteurs calciques :
Ils diminuent le risque de déficit neurologique de cause ischémique, et dans ce groupe, la Nimodipine améliore le pronostic à 3 mois au décours d’une hémorragie sous-arachnoïdienne. La durée du traitement par Nimodipine est de 21 jours. Néanmoins, plusieurs équipes neurochirurgicales arrêtent ce traitement 7 jours après le clippage de l’anévrisme chez les patients ayant un score de Hunt et Hess faible.
§ Traitement du vasospasme : triple-H
- Hypervolémie, hémodilution :
Les patients présentant des symptômes précoces d’ischémie cérébrale et/ou présentant une élévation significative des vélocités sanguines artérielles au doppler transcrânien doivent bénéficier de l’administration intraveineuse de solutés de remplissage afin d’obtenir une hypervolémie (solution d’albumines humaines ou macromolécules). À l’heure actuelle, l’administration de molécules synthétiques n’est pas recommandée chez des patients ayant présenté une hémorragie sous-arachnoïdienne, du fait du risque accru d’induire une coagulopathie. Cette expansion volémique risque d’entraîner une natriurèse excessive, et nécessite de ce fait l’administration de sodium et d’eau en quantité importante.
o Hypertension artérielle induite :
L’utilisation de drogues inotropes positives comme la dobutamine à une dose faible permet d’obtenir une hypertension thérapeutique (pression artérielle systolique entre 18 et 20 cm Hg).
o Angioplastie :
Il consiste en une angioplastie transluminale au ballon des artères cérébrales spasmées, parfois combinée à l’injection intra-artérielle de papavérine. Elle est contre-indiquée chez les patients qui ont présenté une hémorragie sous-arachnoïdienne par rupture d’anévrisme encore non traité, du fait d’un risque nettement accru de resaignement, et chez les patients avec présence d’un infarcissement visualisé au scanner, du fait du risque hémorragique.

1.Traitement de l’hémorragie intraventriculaire et de l’hydrocéphalie :
- Dérivation ventriculaire :
Si le drainage externe est nécessaire plus de 7 à 10 jours, il est nécessaire de remplacer le cathéter par une dérivation ventriculo-péritonéale.
o Fibrinolyse intraventriculaire :
En cas d’hémorragie intraventriculaire avec une hydrocéphalie obstructive conduisant à l’augmentation de la pression intracrânienne, après le traitement étiologique de l’hémorragie sous-arachnoïdienne, il a été proposé un traitement par fibrinolytiques (rt-PA) à une faible dose (4 mg) injecté directement dans les ventricules latéraux, suivi par un drainage alterné ou continu du liquide cérébrospinal sous une faible résistance (2 cmH2O de pression), la réalisation d’un scanner cérébral et l’administration de rt-PA devant être répétées chaque jours, jusqu’à obtenir un nettoyage du système ventriculaire, ce qui se produit en général entre 1 et 3 jours.
o PEC des autres complications :
- Troubles de l’hydratation :
Si l’hyponatrémie est modérée, elle doit être uniquement surveillée ; si la natrémie chute en dessous de 125 mmol/L ou devient symptomatique, il est recommandé d’administrer du sérum salé hypertonique (à 3,5 ou 7 %).
. Diabète insipide :
Le diabète insipide est reconnu par une diurèse supérieure à 300 mL/heure ; le bilan entrée- sortie doit alors être surveillé de près et la diurèse contrôlée par des injections sous-cutanées de 1-désamino-8-D-arginine vasopressine (d DAVP).
- Traitement étiologique +++ : Chirurgie ou radiologie interventionnelle.
B.Stratégie thérapeutique :
- Évaluation de la gravité : Il convient, au terme de l’examen clinique initial, de déterminer le score de la WFNS ou de Hunt et Hess.
2. Prise en charge initiale :
- Pour les patients présentant un bon état clinique à l’admission (grades I à III de H et H) :
- Traitement antalgique adapté ;
- Nimodipine ;
- Hydratation.
- Pour les patients présentant un grade IV et V de Hunt et Hess :
- Mesures de réanimation (intubation, ventilation, sédation) ;
- Monitorage de la pression intracrânienne et drainage ventriculaire ;
- Analgésie ;
- Nimodipine ;
- Hydratation.
Il est recommandé que les patients d’une part de grade HH à V et d’autre part âgés (une limite d’âge est fixée à 70 ans), ou ayant une destruction cérébrale importante à l’examen scannographique, ne reçoivent qu’un traitement palliatif.
3.Traitement étiologique.
- Traitement des complications :Ischémie : triple-H thérapie. Si échec : traitement endovasculaire.Hypertension intracrânienne : mannitol, sédation, dérivation ventriculaire.

I.Pronostic :
- Les facteurs prédictifs importants d’un pronostic péjoratif :
- L’âge avancé ;
- Etat clinique à l’admission défavorable ;
- Hémorragie sous-arachnoïdienne importante ;
- Présence d’une hydrocéphalie ou d’une hémorragie intraventriculaire à l’admission ;
- Présence de tares médicales antérieures.
- Morbidité :
- Handicap +/- sévère ;
- Troubles psychiques ;
- Céphalées chroniques.
- Mortalité :
- Elle est de 30 à 50 %, dont environ 90 % dans le premier mois, constituant de ce fait une étiologie importante de la mortalité des adultes jeunes.
II. Conclusion :
Au total, avec environ un patient sur deux qui décède et la moitié des survivants qui gardent des séquelles, l’hémorragie méningée reste encore une pathologie particulièrement grave. L’amélioration du pronostic passe par un diagnostic plus précoce.
III. Bibliographie
- AHA/ASA Guideline. Guidelines for the management of aneurysmal subarachnoid hemorrhage. A guideline for healthcare professionals from the american heart association/american stroke association. Stroke 2012 ; 43 :1711-37.
- Conférence française d’experts. Hémorragie sous-arachnoïdienne grave. SFAR 2004. www.sfar.org.
- Hantson P. Physiopathologie des lésions cérébrales précoces et retardées dans l’hémorragie sous-arachnoïdienne : avancées récentes. Réanimation 2012 ; 21 : S475- S481.
- Khurana VG, Meissner I, Sohni YR, Bamlet WR, McClelland RL, Cunningham JM, et al. The presence of tandem endothelial nitric oxide synthase gene polymorphisms identifying brain aneurysms more prone to rupture. J Neurosurg 2005 ;102 :526—31.
- Khurana VG, Sohni YR, Mangrum WI, McClelland RL, O’Kane DJ, Meyer FB, et al. Endothelial nitric oxide synthase gene polymorphisms predict susceptibility to aneurysmal subarachnoid hemorrhage and cerebral vasospasm. J Cereb Blood Flow Metab 2004 ;24 :291—7.
- Losser M.R, Payen D. Hémorragie méningée : Prise en charge. Réanimation 2007 ; 16 : 463-471
- Nahed BV, Bydon M, Ozturk AK, Bilguvar K, Bayrakli F, Gunel M. Genetics of intracranial aneurysms. Neurosurgery 2007 ;60 :213—25.

- Rinkel GJ. Intracranial aneurysm screening : indications and advice for practice. Lancet Neurol 2005 ;4 :122—8. [14] Hémorragie sous-arachnoïdienne grave. Texte court. In : Réanimation SFdAed, Franc¸aise AdNdL, Neurochirurgie SFd, Neuroradiologie SFd, ed. Conférence d’experts ; Paris (France), 2004.
- Van Gijn J, Kerr R.S., Rinkel G.J. Subarachnoid haemorrhage. Lancet 2007 ; 369 : 306-318.


